18款特医食品已获批,小议生产许可审查细则意见!
国家市场监管总局发布了“关于公开征求《特殊医学用途配方食品生产许可审查细则(征求意见稿)》”意见的通知,旨在规范特殊医学用途配方食品生产许可活动,加强特殊医学用途配方食品质量安全监管。
一、细则适用范围和发证范围
细则中所称特殊医学用途配方食品,是指为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品。该类产品必须在医生或临床营养师指导下,单独食用或与其他食品配合食用。
其中,特殊医学用途配方食品申证类别名称分为:特殊医学用途配方食品,类别编号 2801;特殊医学用途婴儿配方食品,类别编号 2802。
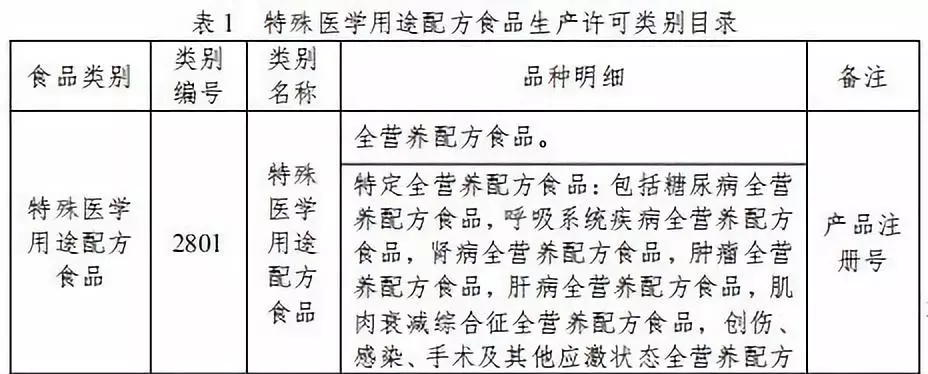

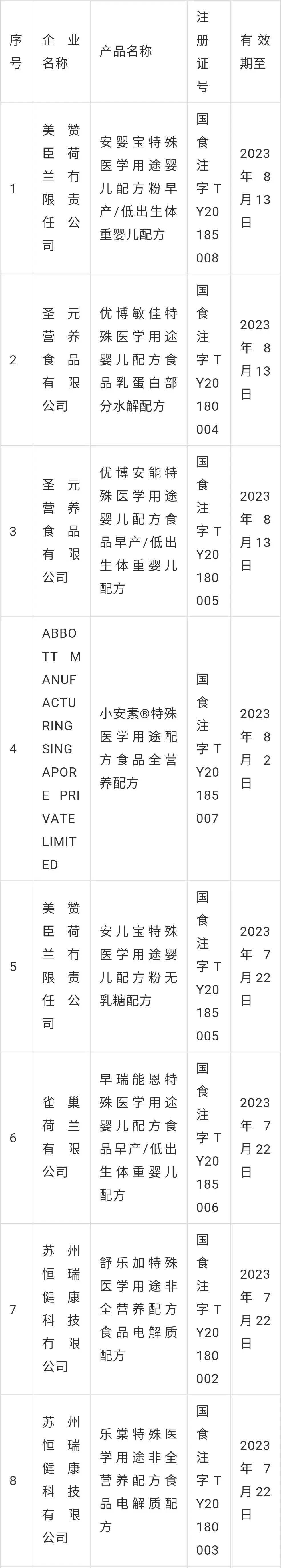
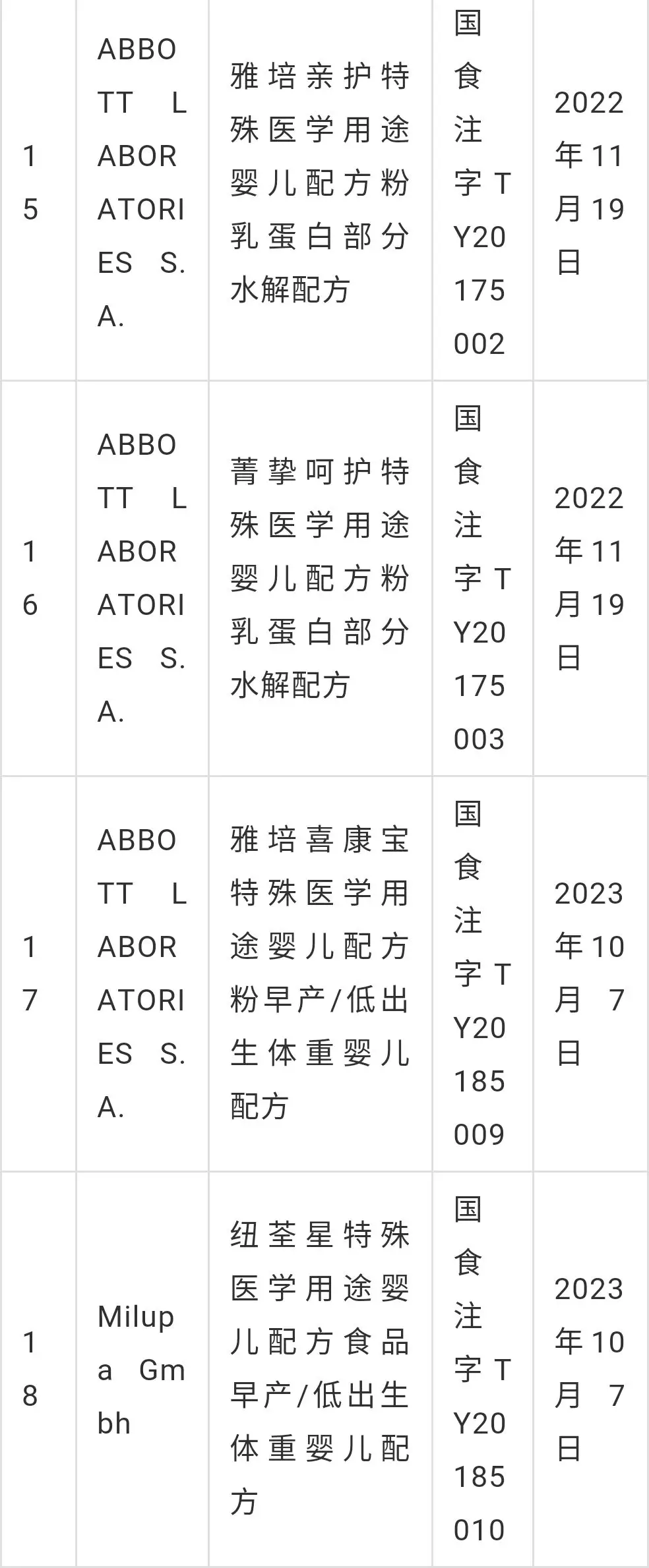
此前,关于特医配方奶粉的注册,我们了解到今年年底前,1岁以下特殊医学用途配方食品产品类别将实现全覆盖。目前特医配方已通过18个系列,圣元2款,贝因美1款,恒瑞健康2款,雀巢1款,美赞臣3款,达能2款,雅培5款。早产/低出生体重婴儿配方通过7款,乳蛋白部分水解配方通过5款,无乳糖配方和非全营养配方食品电解质配方各通过2款,苯丙酮尿症配方和氨基酸配方各通过1款。
特殊医学用途配方食品注册目录信息汇总
(截止2018年10月8日,共批准18个)

二、工艺流程和管理制度(内容节选)
生产设备应当按照工艺流程有序排列,合理布局,便于清洁、消毒和维护,避免交叉污染。工艺流程应当与批准注册的产品配方、生产工艺等技术要求保持一致。
1、建立原料供应商审核制度。
食品原料、食品添加剂和食品相关产品供应商的确定及变更应进行质量安全评估,并经食品安全管理机构批准后方可采购。
采购进口食品、食品添加剂的,还应审核进口商(含国内经销商)的相关证明文件(如授权委托书等);如进行现场质量体系审核的,还应包括现场质量体系审核报告。食品安全管理机构应定期组织对蛋白质(包括蛋白水解物、氨基酸、肽类等)、脂肪(脂肪酸)、碳水化合物以及维生素、矿物质等主要营12养素生产商或者供应商的质量管理体系进行现场审核。
2、建立原料采购验收管理制度。
生产特殊医学用途婴儿配方食品时,所使用的原料和食品添加剂不应含有谷蛋白,加入的淀粉应经过预糊化处理;不得使用氢化油脂、果糖和经辐照处理过的原料;生产 0—6 个月龄的特殊医学用途婴儿配方食品,应使用灰分≤1.5%的乳清粉,或灰分≤5.5%的乳清蛋白粉。
3、建立成品出厂检验管理制度。
生产特殊医学用途婴儿配方食品的,应当自行出厂检验。生产其他特殊医学用途配方食品的,可以委托有资质的第三方检验机构进行出厂成品逐批全项目检验,委托检验项目所需的检验设备设施和试剂,企业可以不再配备。
4、建立产品留样制度。
每批产品均应留样,留样数量应满足复检要求。贮存产品留样的场所应满足产品贮存条件要求。产品留样应保存至保质期满,并有记录。
5、建立产品追溯制度。
应合理划分生产批次,采用产品批号等方式进行标识,建立产品生产批记录和关键控制环节电子信息记录系统,确保对产品进行有效追溯。关键控制环节电子信息记录包括领料、称量、配料、灭菌(或杀菌)、喷雾干燥、干混(干法工艺)、灌装等。
6、建立客户投诉处理管理制度等。
对客户提出的书面或口头意见、投诉,企业相关管理部门应作记录并查找原因,妥善处理。
- 国家市场监督管理总局食品审... 2024-07-26
- 调研 近日,国家市场监督管理总局食品审评中心与东北农业大学联合组成调研组,深入江苏冬泽特医食品有限公司,就婴幼儿配方液态乳的注册...【详细】

