特殊医学用途配方食品相关法规、标准汇总
特殊医学用途配方食品相关法规、标准汇总
1,《食品安全国家标准 特殊医学用途婴儿配方食品通则》
标准代号:GB 25596-2010
颁布机构:原国家卫生部
实施日期:2012年1月1日
主要条款:
本标准适用于0月龄-12月龄婴儿的特殊医学用途配方食品。
2,《食品安全国家标准 特殊医学用途配方食品通则》
标准代号:GB 29922-2013
颁布机构:国家卫生计生委
实施日期:2014年7月1日
主要条款:
本标准适用于1岁以上人群的特殊医学用途配方食品。
3,《食品安全国家标准 特殊医学用途配方食品良好生产规范》
标准代号:GB 29923-2013
颁布机构:国家卫生计生委
实施日期:2015年1月1日
主要条款:
本标准规定了特殊医学用途配方食品生产过程中原料采购、加工、包装、贮存和运输等环节的场所、 设施、人员的基本要求和管理准则。
本标准适用于特殊医学用途配方食品(包括特殊医学用途婴儿配方食品)的生产企业。
4,《食品安全国家标准 预包装特殊膳食用食品标签》
标准代号:GB 13432-2013
颁布机构:国家卫生计生委
实施日期:2015年7月1日
主要条款:
特殊膳食用食品的类别主要包括:
a)婴幼儿配方食品: 1)婴儿配方食品; 2)较大婴儿和幼儿配方食品; 3)特殊医学用途婴儿配方食品;
b)婴幼儿辅助食品: 1)婴幼儿谷类辅助食品; 2)婴幼儿罐装辅助食品;
c)特殊医学用途配方食品(特殊医学用途婴儿配方食品涉及的品种除外);
d)除上述类别外的其他特殊膳食用食品(包括辅食营养补充品、运动营养食品,以及其他具有相应国家标准的特殊膳食用食品)。
5,《食品安全国家标准 预包装食品标签通则》
标准代号:GB 7718-2011
颁布机构:原国家卫生部
实施日期:2012年4月20日
主要条款:
本标准适用于直接提供给消费者的预包装食品标签和非直接提供给消费者的预包装食品标签。
特殊膳食类食品和专供婴幼儿的主辅类食品,应当标示主要营养成分及其含量,标示方式按照 GB 13432执行。
6,《食品安全国家标准 食品生产通用卫生规范》
标准代号:GB 14881-2013
颁布机构:国家卫生计生委
实施日期:2014年6月1日
主要条款:
本标准规定了食品生产过程中原料采购、加工、包装、贮存和运输等环节的场所、设施、人员的基 本要求和管理准则。 本标准适用于各类食品的生产,如确有必要制定某类食品生产的专项卫生规范,应当以本标准作为 基础。
7,《食品安全国家标准 食品经营过程卫生规范》
标准代号:GB 31621-2014
颁布机构:国家卫生计生委
实施日期:2015年5月24日
主要条款:
本标准规定了食品采购、运输、验收、贮存、分装与包装、销售等经营过程中的食品安全要求。 本标准适用于各种类型的食品经营活动。
8,《中华人民共和国食品安全法》
标准代号:中华人民共和国主席令 第二十一号
颁布机构:全国人民代表大会常务委员会
实施日期:2015年10月1日
主要条款:
第七十四条 国家对保健食品、特殊医学用途配方食品和婴幼儿配方食品等特殊食品实行严格监督管理。
第八十条 特殊医学用途配方食品应当经国务院食品药品监督管理部门注册。注册时,应当提交产品配方、生产工艺、标签、说明书以及表明产品安全性、营养充足性和特殊医学用途临床效果的材料。
特殊医学用途配方食品广告适用《中华人民共和国广告法》和其他法律、行政法规关于药品广告管理的规定。
第八十一条 婴幼儿配方食品生产企业应当将食品原料、食品添加剂、产品配方及标签等事项向省、自治区、直辖市人民政府食品药品监督管理部门备案。
婴幼儿配方乳粉的产品配方应当经国务院食品药品监督管理部门注册。注册时,应当提交配方研发报告和其他表明配方科学性、安全性的材料。
将保健食品、婴幼儿配方食品、特殊医学用途配方食品纳入特殊食品,实施严格管理。
婴幼儿配方乳粉是产品配方注册,而特殊医学用途配方食品是产品注册。从管理上讲,特医配注册不但要审查配方的科学性,标签的合规性,还要综合考虑产品的安全性以及营养充足性甚至临床效果等内容,是对产品的整体考量。
9,《特殊医学用途配方食品注册管理办法》
标准代号:国家食品药品监督管理总局令第24号
颁布机构:国家食药监总局
实施日期:2016年7月1日
主要条款:
对在我国境内生产销售和进口的特殊医学用途配方食品实行注册管理。
第九条 申请特殊医学用途配方食品注册,应当向国家食品药品监督管理总局提交下列材料:
(一)特殊医学用途配方食品注册申请书;
(二)产品研发报告和产品配方设计及其依据;
(三)生产工艺资料;
(四)产品标准要求;
(五)产品标签、说明书样稿;
(六)试验样品检验报告;
(七)研发、生产和检验能力证明材料;
(八)其他表明产品安全性、营养充足性以及特殊医学用途临床效果的材料。
申请特定全营养配方食品注册,还应当提交临床试验报告。
10,《婴幼儿配方乳粉产品配方注册管理办法》
标准代号:国家食品药品监督管理总局令第26号
颁布机构:国家食药监总局
实施日期:2016年10月1日
主要条款:
第八条 申请注册产品配方应当符合有关法律法规和食品安全国家标准的要求,并提供证明产品配方科学性、安全性的研发与论证报告和充足依据。
申请婴幼儿配方乳粉产品配方注册,应当向国家食品药品监督管理总局提交下列材料:
(一)婴幼儿配方乳粉产品配方注册申请书;
(二)申请人主体资质证明文件;
(三)原辅料的质量安全标准;
(四)产品配方研发报告;
(五)生产工艺说明;
(六)产品检验报告;
(七)研发能力、生产能力、检验能力的证明材料;
(八)其他表明配方科学性、安全性的材料。
第九条 同一企业申请注册两个以上同年龄段产品配方时,产品配方之间应当有明显差异,并经科学证实。每个企业原则上不得超过3个配方系列9种产品配方,每个配方系列包括婴儿配方乳粉(0-6月龄,1段)、较大婴儿配方乳粉(6-12月龄,2段)、幼儿配方乳粉(12-36月龄,3段)。
11,2017年4月份,总局成立了特殊食品注册管理司,两大类特殊食品的注册管理制正式拉开帷幕。
12,《总局关于给予特殊医学用途配方食品注册管理过渡期的公告》
标准代号:2016年第119号
颁布机构:食品药品监管总局
实施日期:2016年7月1日
主要条款:
特殊医学用途配方食品注册管理过渡期的时间节点为2018年1月1日。2018年1月1日前,经批准在我国境内生产或向我国境内出口的特殊医学用途配方食品,可销售至其保质期结束。自2018年1月1日起,在我国境内生产或向我国境内出口的特殊医学用途配方食品应当依法取得特殊医学用途配方食品注册证书。
13,总局关于发布《特殊医学用途配方食品注册管理办法》相关配套文件的公告(2016年第123号)
标准代号:2016年第123号
颁布机构:食品药品监管总局
实施日期:2016年7月13日
主要条款:
为保障特殊医学用途配方食品注册工作顺利开展,国家食品药品监督管理总局制定了《特殊医学用途配方食品注册管理办法》相关配套文件,包括《特殊医学用途配方食品注册申请材料项目与要求(试行)》、《特殊医学用途配方食品标签、说明书样稿要求(试行)》、《特殊医学用途配方食品稳定性研究要求(试行)》和《特殊医学用途配方食品注册生产企业现场核查要点及判断原则(试行)》。
14,总局关于发布特殊医学用途配方食品临床试验质量管理规范(试行)的公告(2016年第162号)
标准代号:2016年第162号
颁布机构:食品药品监管总局
主要条款:
为规范特殊医学用途配方食品临床试验研究过程,保证临床研究结果的科学性、可靠性,保护受试者的权益并保障其安全,根据《中华人民共和国食品安全法》及其实施条例、《特殊医学用途配方食品注册管理办法》,制定本规范。
15,总局办公厅关于明确进口特殊医学用途配方食品和婴幼儿配方乳粉产品配方注册管理过渡期执行日期问题的复函(食药监办特食管函〔2017〕466号)
标准代号:食药监办特食管函〔2017〕466号
颁布机构:食品药品监管总局
实施日期:2017年7月13日
主要条款:
根据总局《关于给予特殊医学用途配方食品注册管理过渡期的公告》(2016年第119号)和《关于婴幼儿配方乳粉产品配方注册管理过渡期的公告》(2016年第160号)规定,未经注册但2018年1月1日前(不含2018年1月1日)经有关部门批准进口的境外生产的特殊医学用途配方食品和婴幼儿配方乳粉,可以在我国境内销售至其保质期结束。
16,总局关于发布《特殊医学用途配方食品注册申请材料项目与要求(试行)(2017修订版)》《特殊医学用途配方食品稳定性研究要求(试行)(2017修订版)》的公告(2017年第108号)
标准代号:2017年第108号
颁布机构:食品药品监管总局
实施日期:2017年9月5日
主要条款:
对在我国境内生产销售和进口的特殊医学用途配方食品实行注册管理,并详细说明。
17,《关于进口婴幼儿配方乳粉产品配方注册执行日期的公告》
标准代号:2017年第101号
颁布机构:国家食品药品监督管理总局 国家质量监督检验检疫总局
主要条款:
为落实《中华人民共和国食品安全法》相关规定,根据婴幼儿配方乳粉产品配方注册过渡期工作安排,现就有关事宜公告如下:
一、以一般贸易方式进口的婴幼儿配方乳粉,其境外生产企业应当依法获得质检总局注册。
二、境外生产企业2018年1月1日(含)后生产的输华婴幼儿配方乳粉应当依法取得食品药品监管总局产品配方注册,并在产品销售包装的标签上注明注册号。
三、境外生产企业2018年1月1日前生产的婴幼儿配方乳粉,可进口并销售至保质期结束。
18,《关于调整特殊医学用途配方食品注册管理过渡期的公告》
标准代号:2017年第139号
颁布机构:国家食品药品监督管理总局 国家质量监督检验检疫总局
主要条款:
食药监总局和国家质检总局联合发布公告,特医配食品注册管理过渡期“大限”从原来的2018年1月1日延长至2019年1月1日,为企业充分预留了申请注册的时间。
按照规定,从2019年1月1日起,在我国境内生产或向我国境内出口的特殊医学用途配方食品应当依法取得特殊医学用途配方食品注册证书,并在标签和说明书中标注注册号。此外,在我国境内生产或向我国境内出口的特殊医学用途配方食品,生产日期为2018年12月31日(含)以前的,可在我国境内销售至保质期结束。
19,《国家市场监督管理总局职能配置、内设机构和人员编制规定》
颁布机构:政府网
实施日期:2018年7月30日
主要条款:
国家市场监管总局“三定”方案发布,明确了从7月30日起,保健食品、特殊医学用途配方食品和婴幼儿配方乳粉划归特殊食品安全监督管理司(简称特食安监司)管理。这也意味着,奶粉行业和其他营养品企业高度关注的奶粉配方注册和特医食品注册工作,来到一个新阶段。

冬泽特医—关爱患者,专注营养
上海冬泽特医食品有限公司(www.daisyfsmp.com)是医用食品领域的开拓者、创新者、领航者。公司自成立以来,一直专注于特殊医学用途配方食品的研发、生产与推广。专业打造学术服务团队,与关注营养的全国专家们一起推进肠内营养理念与行业发展。
公司在湖南浏阳开发区和江苏南通生物科技园拥有粉剂和液体生产制造基地。上海冬泽特医已经实现了在特医食品领域,国际视野研发平台、全品类产品生产平台、全国市场销售网络平台的全生态产业链闭环。
冬泽特医专业团队富有激情、斗志昂扬,立志打造特医食品国内第一品牌。
特殊医学用途配方食品 简称特医食品,英文缩写:FSMP(Food for Special Medical Purposes)。
特医食品也称肠内营养(药品)、医学营养食品。20世纪70年代,国际上使用EN(肠内营养)与PN(肠外营养)比例为1:9,90年代转变为9:1。
当前共识 只要肠道有功能,首选肠内营养。在我国,EN与PN使用比例约为2:8,肠内营养在我国还有很广阔的应用空间及良好前景。
FSMP定义 “为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品。该类产品必须在医生或临床营养师指导下,单独食用或与其他食品配合食用”。
FSMP分类 全营养配方食品,特定全营养配方食品,非全营养配方食品。
FSMP临床优势 安全性高,使用方便,价格低廉。减少并发症;缩短住院时间;节省治疗费用。
—GB29922-2013《特殊医学用途配方食品通则》

公司致力于特殊医学用途配方食品研发与推广,逐步打造国内最专业的临床营养支持领域高水准的产品研发、学术推广、客户关爱以及健康促进体系,确保所提供的医学营养产品和健康促进服务都是专业、创新、安全、有效、优质的。
企 业 优 势
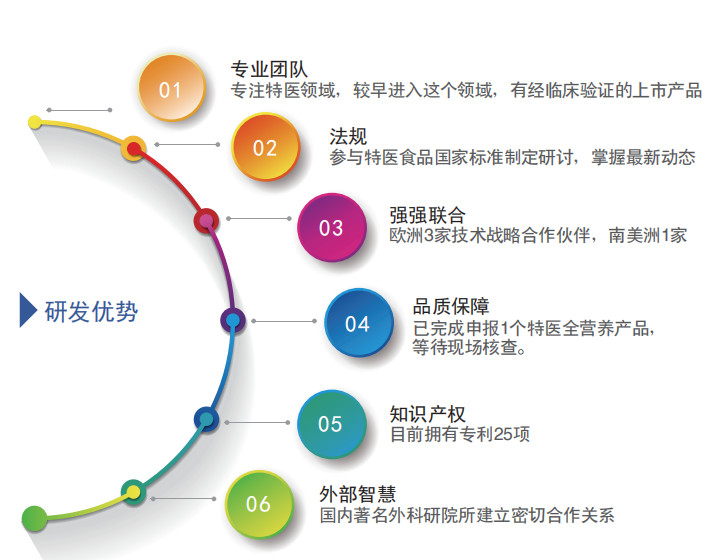
生 产 优 势
江苏冬泽特医食品有限公司位于江苏南通临江镇临江大道,总投资18000万元,建筑面积12501平方米。可年产30000吨粉剂特医食品、900万瓶(袋)液体特医食品。 同时在湖南浏阳开发区拥有生产制造基地。

学 术 优 势
冬泽特医拥有专业化的市场学术服务团队,由国内知名专家牵头,与知名医院营养科联合推广,积极参加各类营养学术会议,在全国各省举办临床营养的宣传活动。为品牌推广奠定了良好的市场和学术基础。发起并承办连续五届特殊医学用途配方食品高峰论坛。
公 司 荣 誉


- 国家市场监督管理总局食品审... 2024-07-26
- 调研 近日,国家市场监督管理总局食品审评中心与东北农业大学联合组成调研组,深入江苏冬泽特医食品有限公司,就婴幼儿配方液态乳的注册...【详细】

